蛋白质降解技术中常用的蛋白酶(一)
蛋白质谱分析前通过蛋白质降解技术对样品进行降解常用到的几种蛋白酶及其裂解特性如下表: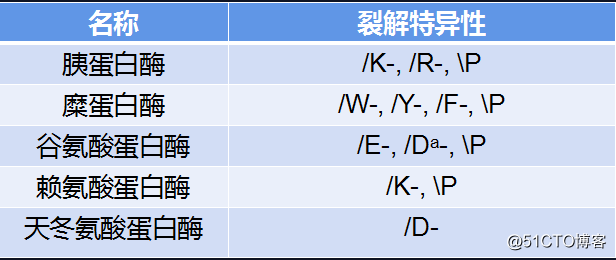
胰蛋白酶
胰蛋白酶是蛋白质谱分析中应用最广泛的蛋白酶。胰蛋白酶主要从猪或牛胰腺中获得,且易于纯化。用甲苯磺酰基-L-氨基联苯氯甲基酮(TCPK)对其进行改性,可以抑制糜蛋白酶的残留。胰蛋白酶一般在赖氨酸和精氨酸残基处对蛋白质进行裂解,除非这两种残基中的任意一种在C-末端方向上接的是脯氨酸残基。赖氨酸和精氨酸残基在许多蛋白质中的间距使得所得到的多数肽的长度都适用于质谱分析。这种“双重专一性”意味着胰蛋白酶能比仅切割一个氨基酸残基的蛋白酶更频繁地切割蛋白质。一般来说,一个50kDa的蛋白质会产生大约30个胰肽。
胰蛋白酶在蛋白质组学研究中的其中一个优势是它能在溶液中和“凝胶”消化过程中都表现出良好的活性。目前已经开发出了许多胰蛋白酶消化或蛋白质在溶液中、凝胶中和膜上印迹的方法,并得到了广泛的测试。此外,经常进行蛋白质组学分析的质谱实验室熟悉胰蛋白酶自溶片段,这些片段不可避免地作为胰蛋白酶消化方法的副产品出现。
谷氨酸蛋白酶(蛋白酶V8)
谷氨酸蛋白酶(Glu-C)是一种内切酶,其残基的羧基侧在醋酸铵或碳酸铵缓冲液中断裂。然而,在磷酸钠缓冲液中,这种酶既能在谷氨酸也能在天冬氨酸残基处断裂。Glu-C也可用于胶内消化。使用Glu-C的一个优点是它能表现出完全不同于胰蛋白酶的切割特异性,提高了获得蛋白质的互补肽片段的可能性。例如,其特异性对于分析赖氨酸和精氨酸含量高的蛋白质特别有用。这些区域可与胰蛋白酶进行大范围的降解,以产生只有很少或没有序列背景的超短肽。
其他蛋白酶和裂解试剂
其他几种酶适用于蛋白质组分析,包括赖氨酸蛋白酶(Lsy-C)、糜蛋白酶、天冬氨酸蛋白酶 (Asp-N)和几种“非特异性”蛋白酶。对于大多数蛋白质组分析实验来说,这些酶的切割特异性通常不太理想。那些只在一个氨基酸残基上裂解的酶更倾向于产生数量更少、长度更长的片段,而这些片段不能提供有用的序列信息,这就是串联质谱分析。另一方面,糜蛋白酶可能切割太频繁(基于其在酪氨酸、苯丙氨酸和色氨酸处的切割能力),从而产生太多缺乏足够序列背景的小肽。然而,这些蛋白酶通常在特定的情况下是有用的,当感兴趣的蛋白质序列不能产生令人满意的胰蛋白酶肽时,特别是在感兴趣的某些区域。
非特异性蛋白酶
使用非特异性蛋白酶是蛋白质水解的另一个潜在有效策略,这些非特异性蛋白酶包括枯草杆菌蛋白酶、胃蛋白酶、蛋白水解酶和链霉蛋白酶等。这些酶随机地对蛋白质进行切割以产生多个重叠的肽。由于相对缺乏特异性,水解必须控制在相对较短的时间内,以防止它们“走远”。产生多个重叠肽的好处是能增加从分析的蛋白质中获得更高百分比序列数据的可能性。
溴化氰
蛋白质也可以被一些化学物质分解。其中应用最广泛的是溴化氰(CNBr),它能在蛋氨酸残基上对蛋白质进行切割。尽管该反应具有高度的特异性,但大多数蛋白质中蛋氨酸残基相对较少,CNBr裂解产生的片段数量就相对较少,长度相对较长。在许多情况下,这些大片段在串联质谱分析中不能产生有用的序列数据。
本文由百泰派克生物科技整理编辑。
百泰派克生物科技基于质谱,提供蛋白质质谱鉴定/质谱分析服务:样品前处理-蛋白还原烷基化后使用高度特异性的蛋白酶进行蛋白样品水解,获得多肽片段;上机分析-通过纳升级色谱(nano-flow)结合高分辨率质谱,在最高的灵敏度下对肽段进行分离并使用超高分辨率质谱仪采集肽段质谱数据;数据库检索-结合样品物种对应的蛋白质数据库对成千上万张质谱图进行分析(使用Uniprot数据库,每月更新一次数据库,以确保访问最新数据),从而实现样品中蛋白的蛋白质质谱鉴定。